2025.06.14-监管科学大会部分报告分享-附下载地址
中国药品监督管理研究会主办的第八届中国药品监管科学大会在京召开,收集了部分大会的报告,分享给大家。2025.6.14 高天兵副主任-药品检查核查工作最新进展2025.6.14 郭术廷副局长 上海药品监管科学研究与监管实践——以细胞和基因治疗药品全链条质量监管为例2025.6.14 贺伟罡CMDE副主任 监管科学助推医疗器械创新发展2025.6.14 刘继红副司长-深入贯彻全面落实深化药品医疗...
2025年第六期“药审云课堂”-课件和培训视频分享
6月6日CDE进行了2025年度第六期药审云培训,本期以“药品注册申报常见问题”为主题,系统展示药品注册申报流程及多层级多渠道沟通交流机制,让公众更好地了解药品审评工作,同时帮助申请人科学高效推进注册申报进程。课程从资料受理与电子提交、审评期间可能遇到的常见问题与解决路径、核查检验启动工作程序及常见问题解答、临床试验期间安全管理等环节切入,讲解药品注册过程中上述环节的关注要点,同时总结提炼常...
执业药师2025年资料分享-持续更新
我用夸克网盘分享了「执业药师2025」,链接:https://pan.quark.cn/s/fa744764ef3f2025某德培训资料,链接: https://pan.baidu.com/s/1LES35oUPs8ZlBiQI1wg2Vw?pwd=ymth 提取码: ymth
江苏药监局发布《药品生产企业质量安全主体责任指导手册(2.0版)》-附下载地址
为深入贯彻落实《中华人民共和国药品管理法》和全国药品监管工作会议精神,推动药品生产企业全链条压实质量安全主体责任,江苏省药监局于近日正式印发《药品生产企业质量安全主体责任指导手册(2.0版)》,并同步启动全省宣贯实施工作。《指导手册》不仅针对不同药品,如原料药,化学药,生物药,特殊药品精麻,中药配方颗粒等分别制定《指导手册》,而且每个指导手册的内容,是非常的丰富,内容主要包括以下几方面:①...
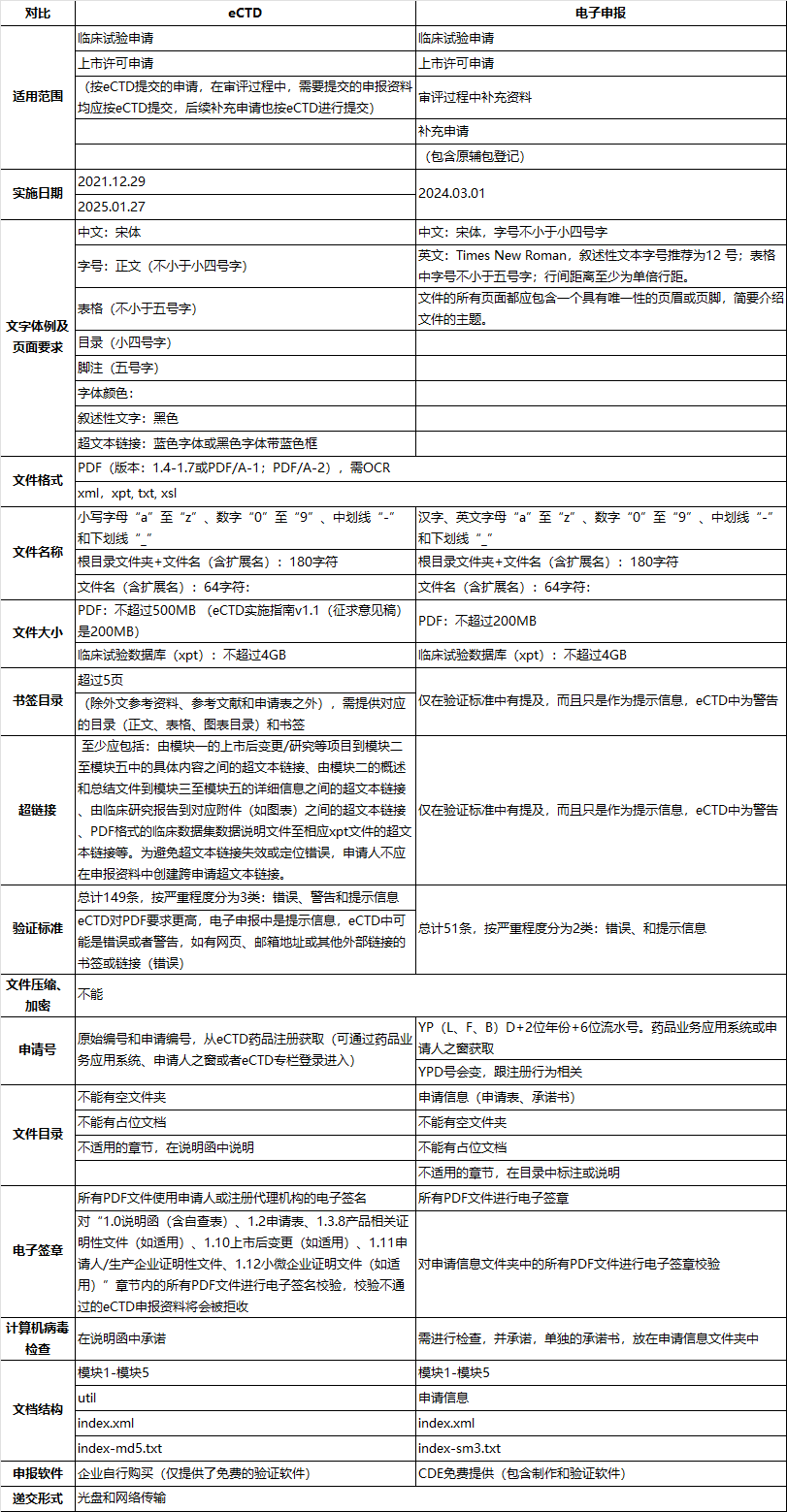
中国eCTD和电子申报差异分析
根据NMPA在2025年1月23日发布的《国家药监局关于扩大药品电子通用技术文档实施范围的公告(2025年第10号)》,自2025年1月27日起,药品电子通用技术文档(eCTD)的实施范围进一步扩大。具体调整如下:1.化学药品:● 化学药品1类至5类的药物临床试验申请;● 化学药品2类、3类、4类、5.2类的上市许可申请2. 生物制品:● 预防用生物制品和治疗用生物制品1类至3类的药物临床试...
中国药典合集(含2025版以及历年所有版本下载地址)
近期新的2025版中国药典已经上市,纸质书想必公司都会进行购买,不过实际工作中大家还是喜欢使用电子版本的药典, 本文分享历年所有药典,并持续更新2025年药典电子版本(目前的版本能用,但不能进行检索)历年电子版本清单见下图下载地址(优先使用夸克网盘的链接,更新频次更快,下载速度也快):2025版药典下载链接(持续更新):https://pan.baidu.com/s/1OwTcqSCAWe1...
国内监管部门关于基因与细胞治疗产品的相关法规要求指导原则汇总
本文主要按照发布时间整理官方的一些技术指导原则,方便查阅相关资料学习。我会持续更新相关内容,如有其他未列出的官方文件,可以留言告诉我,我会持续更新。2017年20171222-总局关于发布细胞治疗产品研究与评价技术指导原则的通告(2017年第216号)https://www.nmpa.gov.cn/ylqx/ylqxggtg/ylqxzhdyz/20171222145101557.html2...
药品注册核查要点与判定原则(药学研制和生产现场)解读
1.背景20200522 CFDI发布了药品注册核查要点与判定原则(药学研制和生产现场)(征求意见稿),其中包含了研制和生产现场核查的要点。本文主要解读下研制现场的相应要求。2.个人解读2.1目的部分(一)药学研制现场核查(本文件以下简称研制现场核查)的目的主要是通过对药学研制情况(包括处方与工艺研究、样品试制、质量控制研究、稳定性研究等)的原始资料进行数据可靠性的核实和/或实地确证,核实申...